Tecnologias de identificação de dispositivos únicos automatizam a identificação médica e a leitura dos códigos de barras
Contributed By DigiKey's North American Editors
2023-10-26
Em 2013, a FDA (Food and Drug Administration) dos EUA implementou o Sistema de Identificação de Dispositivos Únicos ou regra UDI. O objetivo da regra era melhorar a segurança do paciente, fornecendo um método consistente de rastreamento e identificação de dispositivos médicos usando documentação moderna nos pontos de fabricação, distribuição e uso. Assim como os Requisitos da Regulamentação de Dispositivos Médicos na Europa ou regulamentações semelhantes em outros países, a regra UDI dos EUA reforça a precisão dos relatórios e facilita a análise no caso de um recall ou evento adverso.
A partir de 24 de setembro de 2023, a FDA aplicará integralmente o Código Nacional de Itens Relacionados à Saúde e os Números de Código de Medicamentos nos rótulos e embalagens dos dispositivos. Todos os produtos médicos rotulados a partir dessa data devem estar em total conformidade com os decretos da UDI. Esse decreto afetará o seguinte:
- Produtos críticos para a vida de classe 3, como marca-passos e próteses implantadas
- Produtos de classe 2 moderadamente críticos, como seringas, cateteres e suturas absorvíveis
- Produtos de classe 1 de baixo risco, como fio dental, aventais médicos e máscaras de oxigênio
A aplicação total do decreto significa que, se um dispositivo médico não tiver um código de barras digitalizável, ele não será mais considerado um produto válido/utilizável, mesmo que haja rótulos legíveis para pessoas e mesmo que o produto seja considerado facilmente identificável pela maioria dos usuários. Essa aplicação total estimulará a adoção abrangente pelo setor de medicina e pelo faturamento do seguro de saúde.
 Figura 1: Alguns verificadores portáteis de código de barras com marcação direta na peça (DPM) apresentam iluminação avançada e outros softwares para localizar automaticamente os símbolos e percorrer as configurações para otimizar a leitura da marca DPM específica e do substrato do material em questão. De fato, o LVS-9585 mostrado aqui pode verificar tanto as peças DPM quanto as etiquetas impressas para análises e relatórios abrangentes. (Fonte da imagem: Omron Automation)
Figura 1: Alguns verificadores portáteis de código de barras com marcação direta na peça (DPM) apresentam iluminação avançada e outros softwares para localizar automaticamente os símbolos e percorrer as configurações para otimizar a leitura da marca DPM específica e do substrato do material em questão. De fato, o LVS-9585 mostrado aqui pode verificar tanto as peças DPM quanto as etiquetas impressas para análises e relatórios abrangentes. (Fonte da imagem: Omron Automation)
A entidade contratante (detentora da marca) é responsável
Nos EUA, o proprietário do IP e da marca voltada para o usuário de cada produto médico são responsáveis pela precisão e pela qualidade dos códigos UDI. Isso é especialmente importante porque a maioria do mercado de produtos médicos é fabricada por contrato e terceirizada para as instalações de outras organizações. Portanto, é responsabilidade da organização contratante garantir que toda a sua cadeia de suprimentos esteja em conformidade com a UDI e produza etiquetas precisas.
Origens da tecnologia de identificação de dispositivos únicos
As UDIs são identificadores estáticos de dispositivos. No entanto, as alterações na quantidade de itens em um pacote podem desencadear a necessidade de um novo identificador. As agências emissoras determinam como esses detalhes são distinguidos. Da mesma forma, a alteração das condições de esterilidade da embalagem de um dispositivo também pode alterar o identificador do dispositivo. A alteração do mercado de destino de um dispositivo (o país onde o dispositivo será vendido), do idioma do rótulo ou da marcação CE também pode exigir alterações no identificador do dispositivo.
Antes da regra UDI, um fabricante de dispositivos médicos pode ter rotulado um produto com um número de peça específico. O distribuidor mudaria esse número de peça antes que o prestador de serviços de saúde ou o hospital o mudasse novamente. Com a possibilidade de cada entidade alterar o número da peça antes de chegar ao paciente, era quase impossível rastrear produtos, lidar com recalls, evitar falsificações ou solicitar novos estoques com eficiência e precisão.
Relacionado: Implementação de soluções robustas de rastreabilidade
Atualmente, um identificador padronizado e persistente, chamado de UDI, é fornecido a cada dispositivo para permitir a todas as entidades uma identificação mais rápida e precisa do dispositivo, reduzindo, em última análise, os erros médicos. Essa UDI é um código alfanumérico que contém dois dados importantes:
- Um identificador de dispositivo
- Um identificador de produção
Um identificador de dispositivo é uma etiqueta estática atribuída a um determinado dispositivo que lista o rotulador (normalmente o fabricante do dispositivo) e o número específico do modelo do dispositivo. Por outro lado, um identificador de produção contém dados que podem variar, e a maioria dos dados que ele pode conter são opcionais. Isso pode incluir códigos de lote e lote de controle, números de série, datas de validade e datas de fabricação. Em resumo, os dados opcionais podem ser qualquer coisa que um fabricante ou rotulador considere necessária para dar suporte ao rastreamento do dispositivo.
Todo rótulo UDI deve apresentar essas informações de duas formas:
- Formato legível para pessoas (texto simples)
- Formato legível para máquinas (legível por um leitor de código de barras ou RFID)
Sempre que um dispositivo puder atender a várias aplicações médicas, a UDI deverá ser marcada diretamente no dispositivo, e não em sua embalagem. A regra também se aplica a dispositivos que podem ser usados várias vezes.
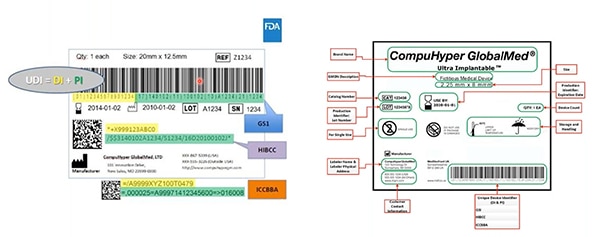 Figura 2: GS1, HIBCC e ICCBBA - agências emissores de UDI - criam UDIs; atribuem simbologia permitida para UDIs; definem quais tecnologias podem fazer interface com UDIs; e especificam a qualidade necessária das marcações de UDI. Destacado em amarelo nesta amostra está o identificador do dispositivo; destacado em verde estão os identificadores de produção. Outros elementos incluem informações legíveis para pessoas... e isso também é codificado no código de barras legível para máquinas. (Fonte da imagem: FDA)
Figura 2: GS1, HIBCC e ICCBBA - agências emissores de UDI - criam UDIs; atribuem simbologia permitida para UDIs; definem quais tecnologias podem fazer interface com UDIs; e especificam a qualidade necessária das marcações de UDI. Destacado em amarelo nesta amostra está o identificador do dispositivo; destacado em verde estão os identificadores de produção. Outros elementos incluem informações legíveis para pessoas... e isso também é codificado no código de barras legível para máquinas. (Fonte da imagem: FDA)
Todos os dispositivos devem ser registrados no banco de dados global de UDI para permitir o rastreamento no caso de um recall e para dar ao público acesso a informações sobre um determinado dispositivo. As agências emissoras credenciadas pela FDA estão autorizadas a criar identificadores únicos para os fabricantes de dispositivos colocarem em seus produtos.
Livro branco relacionado: Mantendo-se atualizado sobre rastreabilidade
Tecnologias e técnicas de varredura da UDI
Os rótulos UDI podem ser verificados de várias maneiras ao longo do seu trajeto, desde a fabricação até o uso.
A verificação na linha de produção é realizada por tecnologias integradas em máquinas maiores para o processamento rápido e preciso de inúmeros produtos à medida que são produzidos. Com o suporte de um software avançado, essas tecnologias ocasionalmente assumem a forma de impressoras de etiquetas de grau industrial. Essas impressoras são capazes de fazer sua própria verificação na linha para confirmar que as informações de UDI são legíveis de acordo com os padrões exigentes do setor, imediatamente após sua criação no ponto de produção da etiqueta. Por exemplo, os verificadores V275 da Omron Automation devem ser usados com impressoras térmicas da Zebra para atender à ISO 15426 e aos padrões GS1 da autoridade emissora para conformidade com a FDA.
Relacionado: Soluções de rastreabilidade da Omron
Em outros lugares, a verificação na linha de produção assume a forma de um sistema de visão especializado que acompanha as esteiras transportadoras nas linhas automatizadas, incorporando a leitura do código de barras para uma verificação extremamente rápida e precisa da rotulagem UDI em produtos de grande diversidade nas linhas de produção de alta velocidade. As ofertas MicroHAWK da Omron Automation se destacam nessa área com sensores avançados complementados por uma construção miniaturizada e opções de conectividade que incluem Ethernet/IP e PROFINET.
Relacionado: Evite a responsabilidade pela rotulagem incorreta
Por outro lado, a verificação UDI fora da linha de produção é a mais adequada para a amostragem de lotes de etiquetas para garantir a qualidade. Geralmente empregada para testes de amostras quando os dispositivos médicos saem ou chegam a uma instalação, a verificação fora da linha pode complementar os sistemas de verificação na linha no início do trajeto de distribuição.
 Figura 3: As UDIs marcadas diretamente nos produtos exigem verificadores diferentes daqueles usados para UDIs impressas em etiquetas anexadas. (Fonte da imagem: Omron Automação)
Figura 3: As UDIs marcadas diretamente nos produtos exigem verificadores diferentes daqueles usados para UDIs impressas em etiquetas anexadas. (Fonte da imagem: Omron Automação)
De fato, todas as operações de distribuição médica e de saúde podem se beneficiar do uso de verificadores em conformidade com a ISO. Considere os produtos de verificação UDI da série LVS 95XX da Omron para uso fora da linha. Eles são empregados:
- Em estações de marcação a laser e impressoras de etiquetas onde os códigos são criados
- Onde os códigos são aplicados a produtos, que podem ou não ser separados da área de criação de códigos
- Em estações de controle de qualidade, onde modelos, formatação e outros elementos de código são confirmados
Especificação das variações do verificador UDI fora da linha
O verificador de UDI mais adequado para uma determinada aplicação fora da linha depende de vários parâmetros.
Tamanho do código de barras: Códigos de barras grandes geralmente são mais fáceis de ler com identificadores que têm um grande campo de visão definido pela distância focal da lente e pelo tamanho do sensor. Considere os identificadores UDI de mesa LVS-9510 da Omron Automation. Essa série de produtos pode ler etiquetas lineares e 2D. Cinco versões diferentes, cada uma com um campo de visão diferente, de modo que os projetistas podem selecionar a versão compatível com o tamanho do código de barras que precisa ser verificado. Um recurso de emenda permite a classificação de códigos de barras que excedem o campo de visão.
Além disso, todos os LVS-9510s podem determinar automaticamente a simbologia e a abertura necessárias para avaliar o código e identificar e destacar pontos problemáticos.
 Figura 4: A verificação dos códigos de barras que atendem os padrões ISO é facilitada com equipamentos que podem verificar códigos lineares (1D) e bidimensionais (2D). Alguns desses equipamentos determinam a simbologia e a abertura necessárias para avaliar códigos e identificam e destacam problemas. O LVS-9510 mostrado aqui tem um recurso de emenda que permite a classificação de códigos de barras maiores do que o campo de visão. (Fonte da imagem: Omron Automação)
Figura 4: A verificação dos códigos de barras que atendem os padrões ISO é facilitada com equipamentos que podem verificar códigos lineares (1D) e bidimensionais (2D). Alguns desses equipamentos determinam a simbologia e a abertura necessárias para avaliar códigos e identificam e destacam problemas. O LVS-9510 mostrado aqui tem um recurso de emenda que permite a classificação de códigos de barras maiores do que o campo de visão. (Fonte da imagem: Omron Automação)
Tipo de código de barras: Os scanners devem ler os formatos de código de barras atribuídos pelos órgãos emissores, conhecidos como HIBCC, ICCBBA ou (mais comumente a partir de 2023) GS1. O GS1 determina o tamanho, o formato e a resolução de UPCs, códigos de barras lineares e códigos de barras de matriz de dados 2D.
Localização da marcação UDI: Considere a marcação direta na peça (DPM) de dispositivos médicos. Essas marcações podem ser incrivelmente pequenas, especialmente quando identificam instrumentos cirúrgicos e dispositivos médicos implantáveis. Para ler e verificar essas UDIs DPM, os verificadores portáteis de ultra-alta densidade LVS-9580 e LVS-9585 da Omron apresentam uma lente especializada que pode classificar uma grande variedade de DPMs, incluindo aquelas com tamanhos de célula de até 50,8 micrômetros. As lentes de grau industrial dentro do LVS-9580 e do LVS-9585 garantem uma precisão de leitura consistente. As mais sofisticadas são as tecnologias de iluminação altamente controláveis e calibráveis dentro dos scanners. Aliada a vários campos de visão, a iluminação permite a otimização imediata das imagens UDI capturadas. Isso é particularmente importante, pois o padrão de código não permite correções ou manipulações de imagem após o fato.
Mais sobre o software do scanner UDI
Para obter o máximo de eficácia, o software UDI para dar suporte ao hardware verificador deve apresentar informações de diagnóstico em um formato intuitivo. Esse software deve classificar os códigos UDI de acordo com os parâmetros definidos pela ISO (principalmente para confirmar sua legibilidade) e, idealmente, também deve rastrear a piora dos problemas em uma série de varreduras de UDI.
A Omron inclui todo o software necessário com cada um de seus hardwares de varredura de UDI. O software é atualizado regularmente para acompanhar a rápida evolução dos regulamentos e da nova legislação do setor.
Uma das principais funções do software do scanner Omron é lidar com a sintaxe do código. Em resumo, todo código de barras ou código 2D deve extrair com precisão todas as informações pertinentes, incluindo tipo de produto, número de lote, quantidade, conforme aplicável, data de validade, informações de remessa, etc. As cadeias de dados resultantes devem ser formatadas de uma maneira específica para acompanhar a evolução dos requisitos, das metodologias e dos destinos dos produtos médicos.
O software atualizado regularmente pelo fabricante do scanner garante que os usuários finais permaneçam atualizados mesmo quando novos códigos são lançados.
Conclusão
O exército dos EUA já teve o objetivo de empregar totalmente um sistema de rastreamento de produtos UID, como o sistema UDI do setor de medicina. Seu objetivo era reduzir o enorme desperdício associado a suprimentos perdidos, duplicados e não contabilizados em instalações militares, incluindo tudo, desde armamentos completos da Raytheon até placas de controle fornecidas por uma pequena empresa para alguma aplicação especializada. Atualmente, os UIDs têm níveis de uso variados.
O mesmo não acontecerá com o decreto da UDI.
O mantra que leva à adoção da UDI é simples: O rótulo é o produto. Afinal, um rótulo incorreto pode causar uma cadeia de eventos que desperdiça o tempo da equipe médica e faz com que o dispositivo médico seja jogado fora. Portanto, as UDIs devem aparecer em todas as camadas da embalagem, como no nível da unidade, do pacote, do maço, da caixa e do palete. As UDIs em dispositivos médicos estéreis dentro de selos de esterilização são especialmente importantes, pois é inaceitável romper o selo para verificar o tipo de dispositivo.
Com a exigência da FDA de adesão total às diretivas UDI a partir de 24 de setembro de 2023, as tecnologias avançadas de varredura para verificação de produtos médicos se tornarão fundamentais para os fabricantes de automação, bem como para os construtores de máquinas e usuários finais que eles atendem.
Esses scanners podem atender a requisitos extremamente específicos de UDI da FDA para confirmar rótulos em uma ampla variedade de equipamentos laboratoriais, médicos e de diagnóstico clínico. Os verificadores de código de barras fora da linha de produção maximizam a rastreabilidade, o sistema de visão na linha e os leitores DPM avançados.

Disclaimer: The opinions, beliefs, and viewpoints expressed by the various authors and/or forum participants on this website do not necessarily reflect the opinions, beliefs, and viewpoints of DigiKey or official policies of DigiKey.









